重磅!国内著名医疗机构证实创新中成药有效抑制乳腺癌干细胞!
乳腺癌成为全球女性最为常见的恶性肿瘤之一,目前手术、放疗、化疗、内分泌治疗和分子靶向治疗等多种治疗方法在一定程度能够延长生存期,但仍有一部分患者因复发转移离世。因此,寻找新的治疗途径和药物仍然重要。
乳腺癌的发生往往是一个渐进的过程,通常始于乳腺上皮细胞的异常增生和乳腺导管增生,而非典型增生更是被视为乳腺癌的癌前病变。乳腺癌干细胞(CSCs)是肿瘤细胞的一个亚组,它们具有自我更新的能力,多能性和高致瘤性。CSCs可以通过募集各种免疫细胞并与之相互作用来逃避免疫破坏,促进免疫抑制性肿瘤微环境的建立。肿瘤免疫微环境由多种免疫细胞组成,包括肿瘤相关巨噬细胞(TAMs)、自然杀伤细胞、骨髓源性抑制细胞(MDSC)、调节性T细胞(Tregs)、细胞毒性T淋巴细胞(CTLs)和辅助性T细胞(Th)。巨噬细胞是包括乳腺癌在内的多种恶性肿瘤中最丰富的免疫细胞。M2型巨噬细胞在人类肿瘤中占主导地位,并产生促生长趋化因子,促进肿瘤生长。TAMs的浸润创造了一种支持癌症发生和分泌多种细胞因子,促进癌症血管生成和侵袭,并抑制抗肿瘤免疫的炎症状态。TAMs也与促进乳腺癌的生长和转移有关。
金蓉颗粒(消癖颗粒)获得了国家药品监督管理局的批准,正式成为治疗乳腺增生症的新选择。其实金蓉颗粒已经作为院内制剂在临床上运用了数十年,经过大约450多万患者的验证,因独特的治疗优势获得广泛的认可和荣誉,包括国家科技重大专项和国家科学技术二等奖等。
一篇名为“XIAOPI Formula Inhibits Breast Cancer Stem Cells via Suppressing TumorAssociated Macrophages/C-X-C Motif Chemokine Ligand 1 Pathway” 的研究论文验证了金蓉颗粒抑制乳腺癌干细胞的作用。

图1 论文首页
一、金蓉颗粒在共培养体系中显著抑制乳腺癌细胞增殖和集落形成能力
在肿瘤微环境中,癌细胞与多种细胞共存,TAMs占比最高,且多呈免疫抑制的M2样表型,会促进肿瘤生长并增强其耐药性。
研究采用了MTT法检测金蓉颗粒对乳腺上皮细胞和乳腺癌细胞的生长抑制作用。结果显示金蓉颗粒处理24h或48h后只能适度抑制人乳腺癌细胞MDA-MB-231和小鼠乳腺癌细胞4T1的增殖。然而在2周培养期间金蓉颗粒可显著抑制乳腺癌细胞MDA-MB-231和4T1的集落形成能力(图2B),同时对正常乳腺细胞MCF-10A无显著抑制作用,表明金蓉颗粒对乳腺癌细胞增殖有长期抑制作用。在有TAMs存在的Transwell共培养系统下,金蓉颗粒处理48h后亦能够显著抑制共培养体系中MDA-MB-231和4T1这两种乳腺癌细胞的集落形成能力。
所以金蓉颗粒可显著抑制乳腺癌细胞增殖与集落形成,尤其是与TAMs共培养时。
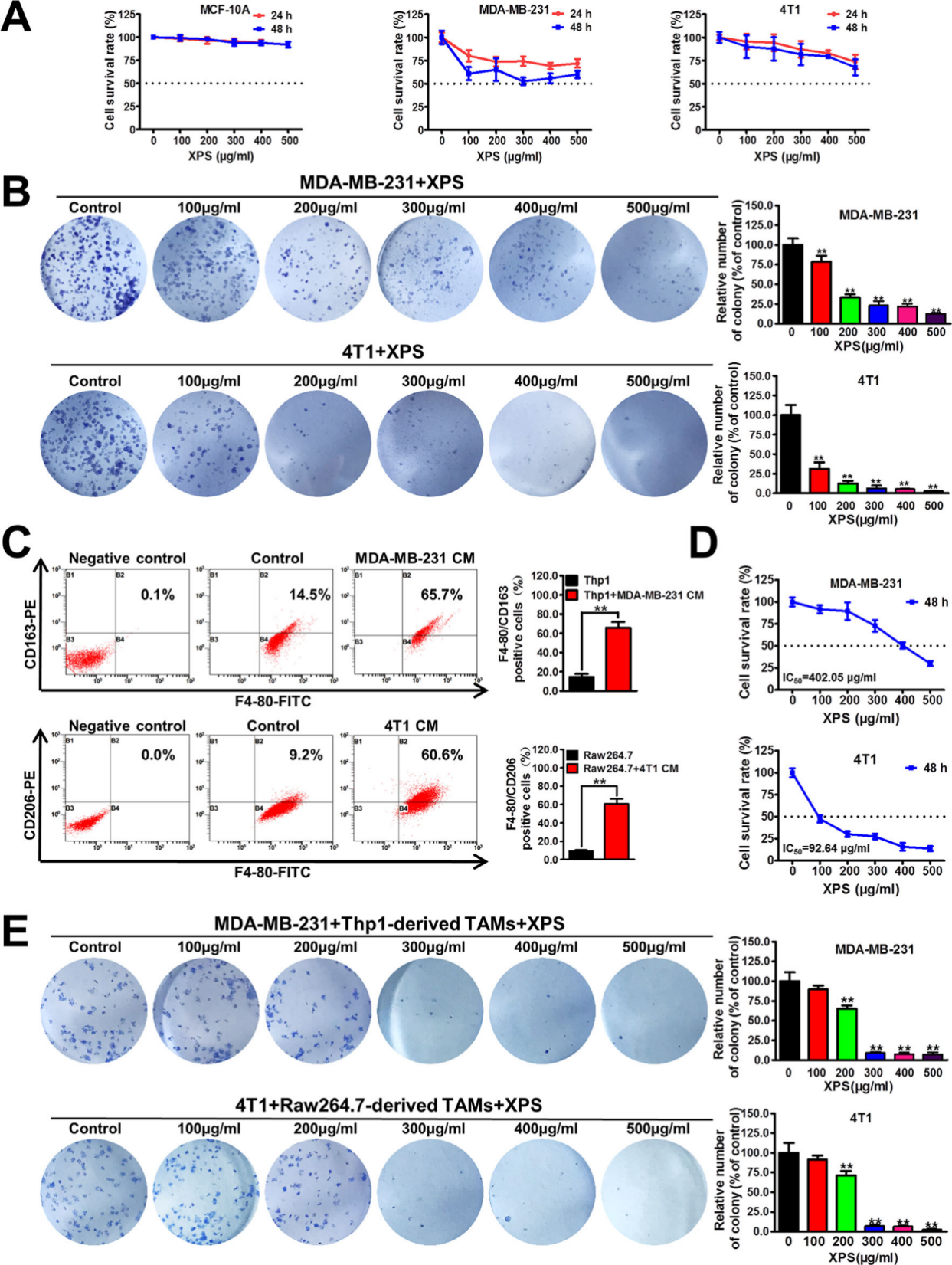
图2 金蓉颗粒显著抑制乳腺癌细胞增殖和集落形成能力
二、金蓉颗粒抑制乳腺癌细胞和TAMs共培养系统中乳腺CSCs的自我更新活性
乳腺CSCs是乳腺癌细胞增殖和生长启动细胞,研究发现金蓉颗粒能显著降低MDA-MB-231和4T1细胞中ALDH+亚群比例(图3A),降低乳腺癌细胞和TAMs共培养体系中乳腺微球数量(图3B)。研究中采用QPCR方法检测金蓉颗粒对乳腺癌细胞共培养体系中干细胞相关基因表达水平的影响(图3C),结果显示金蓉颗粒可以显著减弱包括β-catenin、OCT4和Nanog等干细胞相关基因的表达水平。蛋白质印迹法分析进一步证实金蓉颗粒能显著降低降低β-连环蛋白表达水平(图3D),表明金蓉颗粒可抑制共培养系统中乳腺CSCs自我更新活性。
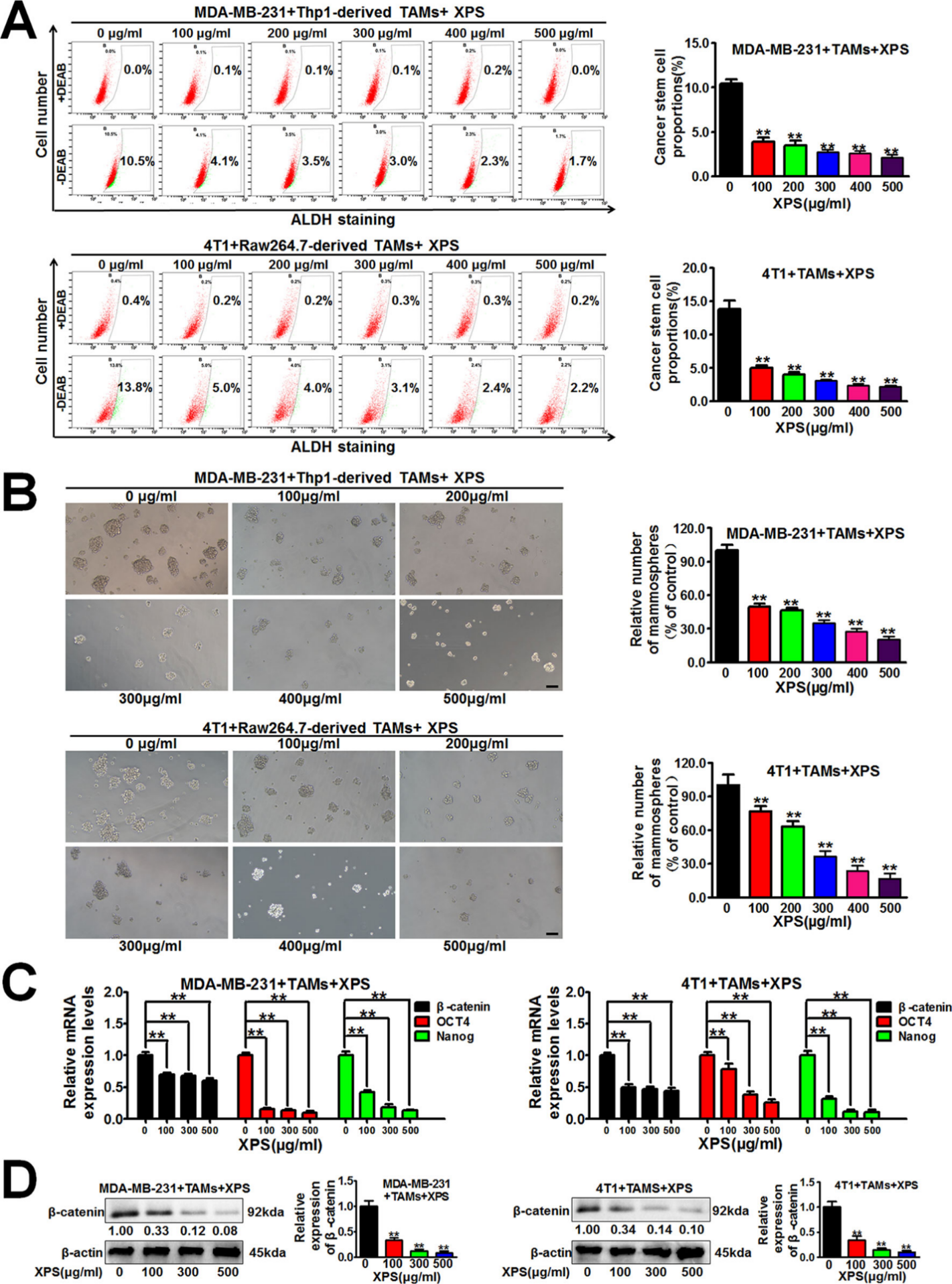
图3 金蓉颗粒抑制乳腺癌细胞和TAMs共培养系统中乳腺CSCs的自我更新活性
三、金蓉颗粒抑制M2表型极化、CXCL1表达和TAMs的分泌
大量研究显示,肿瘤微环境中TAMs可以促进肿瘤的生长,通常表现出促肿瘤生长的M2表型,并增强对治疗的耐药性。研究结果显示金蓉颗粒能显著抑制乳腺癌细胞条件培养基诱导TAMs的 M2表型极化(图4B)。酶联免疫吸附试验表明,金蓉颗粒能显著抑制TAMs分泌CXCL1,呈剂量依赖性(图4C)。蛋白质印迹法和实时荧光定量(QPCR)结果进一步证实,金蓉颗粒能显著抑制人和小鼠TAMs中CXCL1蛋白表达水平(图4D,E)和mRNA转录(图4F),且呈剂量依赖性。研究通过双荧光素酶报告基因实验表明,金蓉颗粒能抑制肿瘤细胞CXCL1基因的启动子活性。
金蓉颗粒可抑制TAMs的分泌及M2表型极化,可以抑制CXCL1的表达,阻断其在乳腺癌发展中的促进作用,从而改善肿瘤微环境。
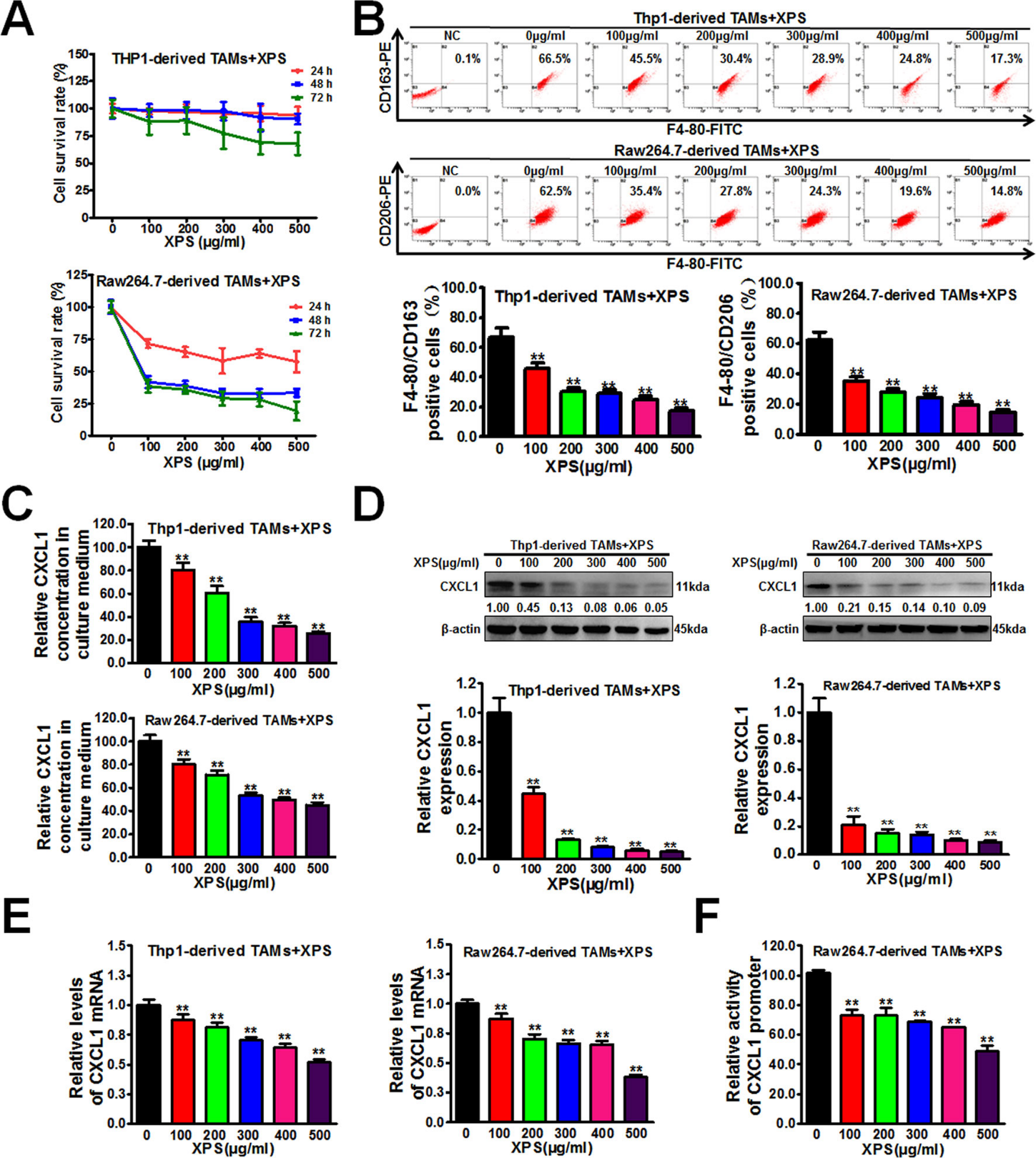
图4 金蓉颗粒抑制M2表型极化、CXCL1表达和TAMs的分泌
四、金蓉颗粒通过调控TAMs/CXCL1通路抑制乳腺CSCs
金蓉颗粒能抑制乳腺癌细胞CXCL1表达,进一步的机制研究证实,TAMs/CXCL1是金蓉颗粒在共培养体系中抑制乳腺癌症干细胞(CSCs)自我更新的关键靶点。研究发现,CXCL1能促进乳腺癌细胞中的ALDH+亚群和乳腺微球数量,增强干细胞相关基因表达,并抵消金蓉颗粒对乳腺癌CSCs和乳腺微球形成的抑制作用,这明确了消癖颗粒发挥作用的关键分子靶点,为深入理解其作用机制提供了重要依据。因此,金蓉颗粒能够通过抑制TAMs/CXCL通路来抑制乳腺癌细胞和TAMs共培养系统中CSCs的自我更新活性
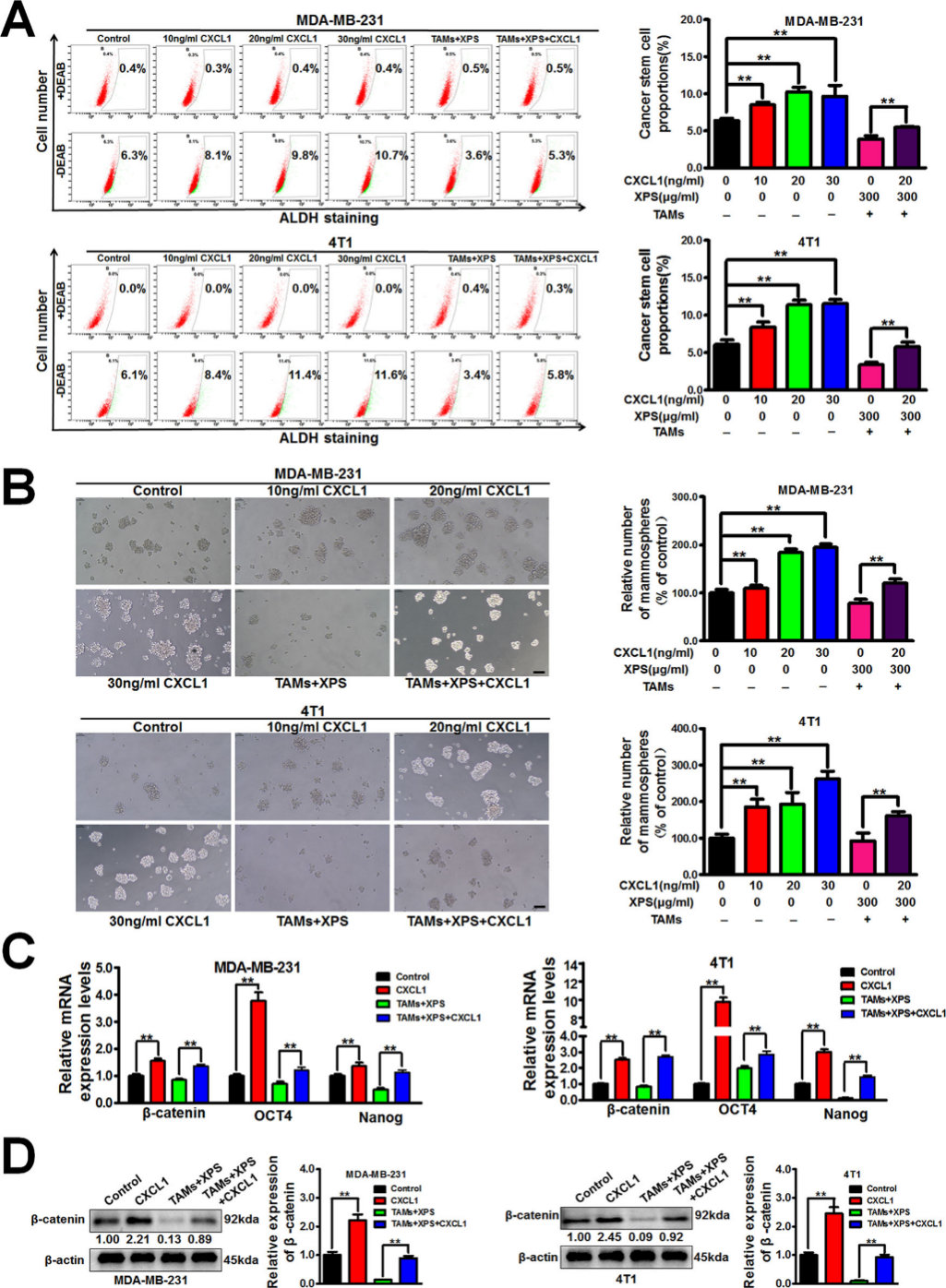
图5 金蓉颗粒通过调控TAMs/CXCL1通路抑制乳腺CSCs
五、金蓉颗粒在体内抑制乳腺肿瘤生长及乳腺CSCs活性
在小鼠4T1-Luc异种移植体内实验中,金蓉颗粒具有抗乳腺癌活性,能抑制乳腺肿瘤的生长和转移(图6A),同时没有观察到治疗相关的死亡率或体重明显下降(图6C),这意味着金蓉颗粒给药不会引起额外的毒性和副作用。
另外体外研究结果一致,金蓉颗粒还能显著降低4T1-Luc异种移植物体内巨噬细胞的浸润程度和M2表型极化,能抑制乳腺组织中CXCL1的表达(图6D、E)。此外金蓉颗粒能显著降低4T1-Luc异种移植物中ALDH+亚群的比例,抑制ALDH1A1的表达,表明金蓉颗粒能抑制体内乳腺CSCs的活性(图6F、G),进一步证实了金蓉颗粒在体内通过调节TAMs/CXCL1通路实现这些效果,而且实验过程中,没有检测到金蓉颗粒对小鼠产生任何明显的副作用,这为其在临床应用中的安全性提供了有力支持。
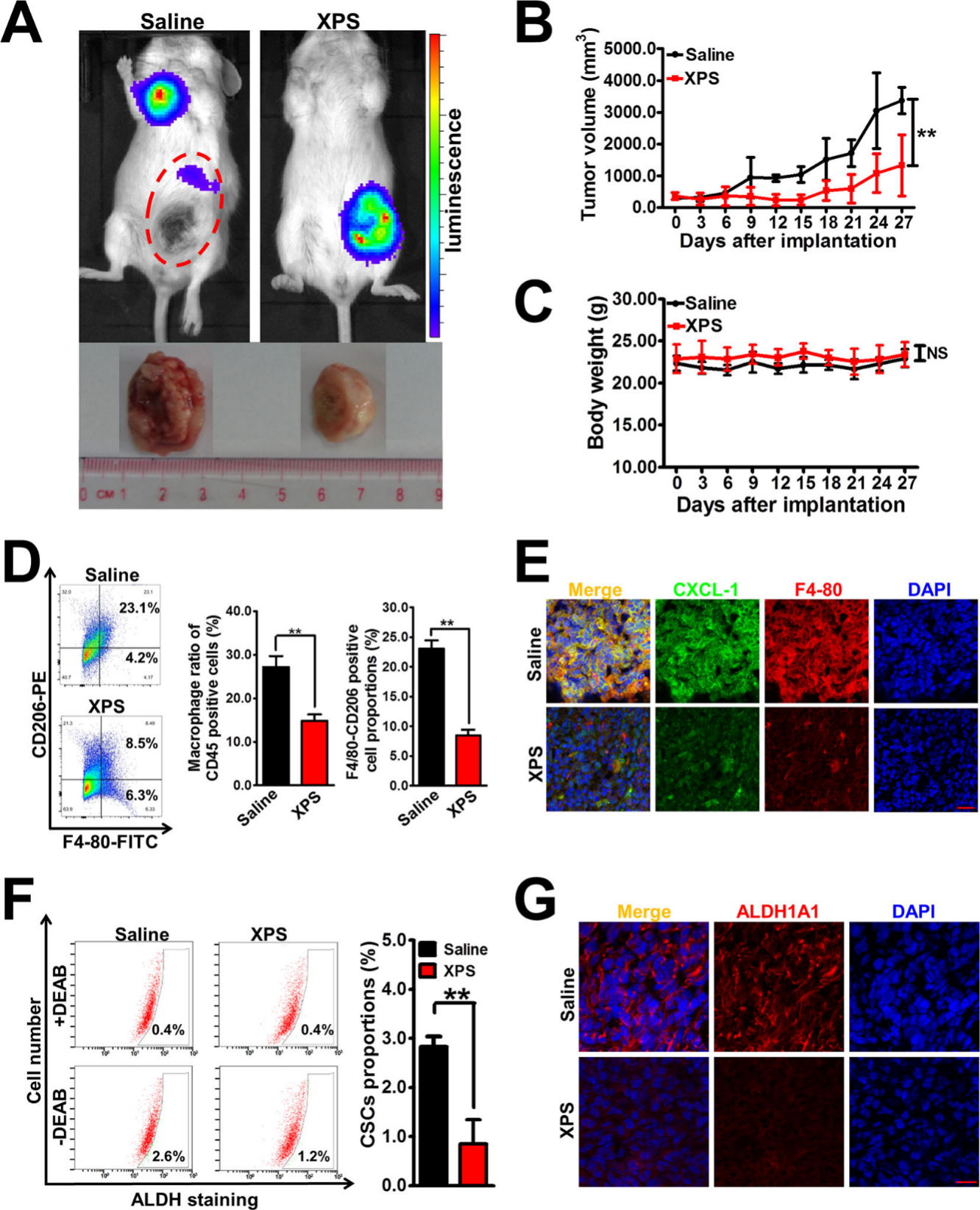
图6 金蓉颗粒在体内抑制乳腺肿瘤生长及乳腺CSCs活性
金蓉颗粒能通过阻断CXCL1介导的TAMs与CSCs之间的相互作用而抑制乳腺癌的生长。本研究不仅揭示了金蓉颗粒在乳腺癌治疗中的免疫调节机制,而且为TAMs/CXCL1作为乳腺CSCs消除的潜在分子靶点提供了新的见解。
(本文内容源自公开发表的科学研究,用药请遵医嘱)
参考文献:Wang S, Liu X, Huang R, et al. XIAOPI Formula Inhibits Breast Cancer Stem Cells via Suppressing Tumor-Associated Macrophages/C-X-C Motif Chemokine Ligand 1 Pathway. Front Pharmacol. 2019;10:1371. Published 2019 Nov 15. doi:10.3389/fphar.2019.01371
关注我们:获取更多抗癌资讯与健康科普!
来源: 奇绩金蓉


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 奇绩仟金方
奇绩仟金方 
