在保证细胞产品质量的情况下,通过选择合适的给药途径,可以保证一定的临床有效性。间充质干细胞产品要发挥疗效,针对患者的有效评估也是一个重要因素。如果提前评估,并对不同患者采取相应措施,可以增强间充质干细胞的临床效果。
-01-
患者的细胞毒性反应
患者疾病情况
除了细胞毒性反应,与患者疾病微环境也可影响间充质干细胞的治疗效果。在某些适应症中,早期治疗可达到最大的治疗效果,要优于晚期治疗。
Athersys公司开展一项临床试验2期(NCT01436487),MSCs产品Multistem用于治疗缺血性卒中。虽然临床结果是失败的,因为在神经功能方面没有改善。但回顾分析显示,与卒中发作36-48小时治疗的患者相比,卒中发作36小时内的患者接受治疗的预后有所改善。为了充分利用Multistem再生能力的时间依赖性,接下来的临床试验3期(NCT03545607)将选择卒中后36小时内进行。
临床前研究表明,间充质干细胞进入机体后,所处的组织微环境可能是不同疾病阶段治疗效果的一个重要因素。疾病微环境中的炎症,缺氧和ECM是动态的,并且都可以影响进入体内间充质干细胞的功能。
首先,当炎症高时,MSCs抑制GVHD的能力似乎更高,而炎症低时,MSCs的抑制力更低。 其次,缺氧条件下的MSCs可诱导分泌各种活性分子,并增强其血管生成和再生能力。 第三,与在软性的胶原蛋白3D支架中植入的MSCs相比,植入在硬性表面上的MSCs 降低了异体淋巴细胞活化的抑制作用。ECM的刚度与纤维化疾病的严重程度呈正相关,在患者之间差异很大。
随着炎症,缺氧和ECM的变化,T细胞受损数量的增加也可能影响间充质干细胞在体内的治疗效果。例如,GVHD中的效应T细胞从疾病早期的不可检测增加到晚期的90%。因此,在晚期GVHD中输注同样数量的间充质干细胞,就会显得不足,因为它们实质上被效应T细胞所超过。
患者疾病状态的合理评估,将有助于优化给药方案并改善对间充质干细胞的临床预测。
患者其他因素
还有一些因素,也可能影响间充质干细胞向疾病部位的募集,进而影响治疗结果。例如,毛细血管(直径:约10~15μm)会捕获静脉输注的间充质干细胞(直径:约20μm),也就是说间充质干细胞很容易很卡住,影响了间充质干细胞归巢至其他器官的能力。此外,间充质干细胞归巢依赖趋化因子的分泌,因为宿主中靶器官的趋化因子分泌的量可能不足以有效地募集间充质干细胞。
-02-
患者选择的解决方案
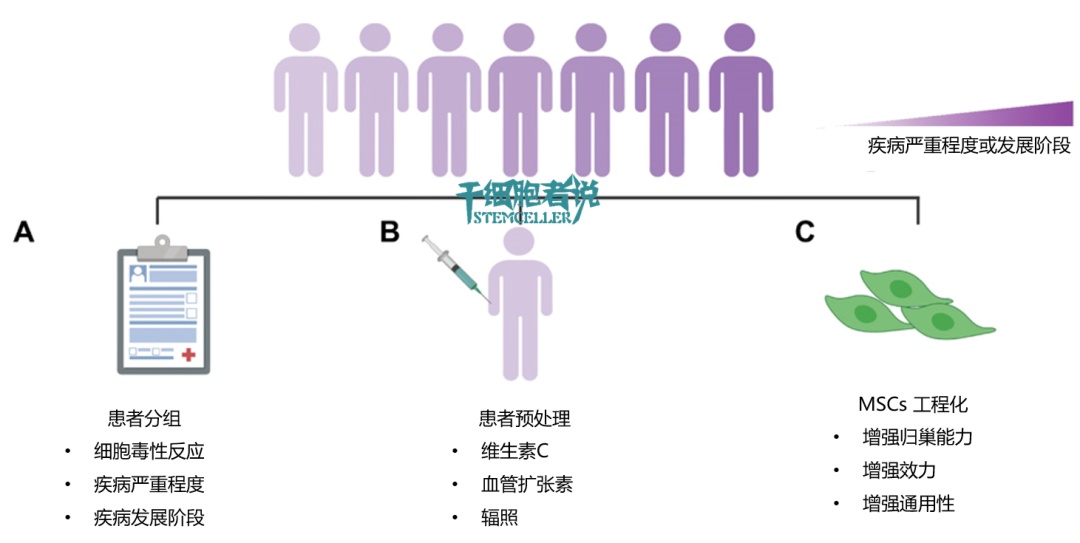
 患者分组
患者分组
对“患者”预处理
尽管宿主预处理仍处于临床前阶段,但维生素C预处理,辐射处理,血管舒张等研究可能代表了一种增强间充质干细胞效力的新策略。
改造患者体内组织微环境,是提高间充质干细胞效力和响应速度的另一条途径。例如,维生素C具有防止氧化,从而减少对移植细胞的损害的能力。在脊髓损伤模型中,与单独使用间充质干细胞或维生素C相比,腹膜内注射维生素C并在脊髓损伤部位局部注射间充质干细胞具有更好的治疗效果。
▉ 血管扩张素处理
静脉输注间充质干细胞前,可先对患者使用血管扩张素,避免间充质干细胞在患者毛细血管的滞留。临床前研究表明,使用血管扩张剂,肺中间充质干细胞的积聚减少了15%,间充质干细胞向骨髓的归巢增加了10%至50%。
▉ 辐照处理
增强患者靶器官的趋化因子分泌也可提高间充质干细胞归巢。临床前研究表明,在静脉输注间充质干细胞前,经辐照的动物体内的间充质干细胞归巢至骨髓的数量,比未辐照增加了两倍。其机理是,辐照增加了动物受损骨髓部位SDF-1的分泌,这促进了受辐照人群中间充质干细胞归巢的改善。
间充质干细胞工程化
-03-
间充质干细胞面临的巨大挑战
值得一提的是,小鼠试验并不能代表人体试验。临床前小鼠试验通常具有局限性。小鼠试验中使用的输注体积和细胞数量也与临床患者不同。比如,间充质干细胞的静脉输注剂量,小鼠通常为5X10*7/kg,人类通常为1~2 X10*6/kg。不同剂量可以影响治疗效果,因为间充质干细胞分泌的旁分泌因子取决于细胞数量。因此,许多有希望的临床前结果不能转化为临床成功。未来,探索使用大动物模型,可以更好地模拟患者疾病状况和临床环境中的给药方案。
-04-
小结与展望

来源: 干细胞者说


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 干细胞者说
干细胞者说 
