氢化铝锂是一个复合氢化物,白色或灰白色结晶体,分子式为LiAlH4。氢化铝锂缩写为LAH,是有机合成中非常重要的还原剂,尤其是对于酯、羧酸和酰胺的还原。纯的氢化铝锂是白色晶状固体,在120°C以下和干燥空气中相对稳定,但遇水即爆炸性分解。1
氢化铝锂对人体的黏膜、上呼吸道、眼睛及皮肤有强烈刺激性,因此接触人员应做好防护措施。1
概述图引自2。
物性数据
|| ||
结构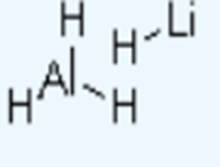
图片引自4。
制备Schlesinger 法1947年, Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是令氢化锂与无水三氯化铝在乙醚中进行反应:4LiH + AlCl3 −Et2O→ LiAlH4 + 3LiCl,这个反应一般称为 Schlesinger反应,反应产率以三氯化铝计算为86%。反应开始时要加入少量氢化铝锂作为引发剂,否则反应要经历一段诱导期才能发生,并且一旦开始后会以猛烈的速度进行,容易发生事故。Schlesinger 法有很多缺点,如需要用引发剂、氢化锂要求过量和高度粉细、需要用稀缺的原料金属锂、反应中3/4的氢化锂转化为价廉的氯化锂等。虽然如此,相对于其他方法,Schlesinger 法较简便,至今仍是制取氢化铝锂的主要方法。1
高压合成法用碱金属或氢化物,铝,高压氢在烃或醚溶剂中反应。反应方程式为:LiH + Al + 2H2 → LiAlH4。1
工业合成上一般采用高温高压合成氢化铝钠,然后与氯化锂进行复分解反应。这一制备方法可以实现氢化铝锂的高产率:Na + Al + 2H2 → NaAlH4,NaAlH4 + LiCl −Et2O→ LiAlH4 + NaCl。其中LiCl由氢化铝锂的醚溶液过滤掉,随后使氢化铝锂析出,获得包含1%左右LiCl的产品。上述的氢化铝钠若换成氢化铝钾也可反应,可与氯化锂或是乙醚或四氢呋喃中的氢化锂反应。1
提纯与存放氢化铝锂是白色固体,但工业品由于含有杂质,通常为灰色粉末。氢化铝锂可以通过从乙醚中重新结晶来提纯,若进行大规模的提纯可以使用索式提取器。一般来说,不纯的灰色粉末用于合成,因为杂质是无害的,可以很容易地与有机产物分离。1
纯氢化铝锂粉末是在空气中自燃,但大块晶体不易自燃。一些氢化铝锂工业品中会包含矿物油,以防止材料与空气中的水反应,但更通常的作法是放入防水塑料袋中密封。1应储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过32℃,相对湿度不超过75%。应与氧化剂、酸类、醇类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。2
相关反应热分解反应氢化铝锂在常温下是亚稳的。在长时间的贮存中,氢化铝锂会分解成Li3AlH6和LiH。这一过程可以通过钛、铁、钒等助催化元素来加速。当加热氢化铝锂时,其反应机理分为3步:1
3LiAlH4 → Li3AlH6 + 2Al + 3H2↑(R1)1
2Li3AlH6 → 6LiH + 2Al + 3H2↑(R2)1
2LiH + 2Al → 2LiAl +H2↑(R3)1
R1通常以氢化铝锂的熔化开始,温度范围为150~170℃,接着立即分解为Li3AlH6,但是R1是在低于LiAlH4熔点的情况下进行的。在大约200℃时,Li3AlH6分解成LiH和Al(R2),接着在400℃以上分解成LiAl(R3)。反应R1在实际中是不可逆的,而R3是可逆反应,在500℃时的平衡压强是25千帕。在有适当催化剂的情况下,R1和R2反应可以在常温下发生。1
水解反应LiAlH4遇水立即发生爆炸性的猛烈反应并放出氢气:1
LiAlH4 + 2H2O → LiAlO2 + 4H2↑1
LiAlH4 + 4H2O → LiOH +Al(OH)3+ 4H2↑1
由于放出的氢是定量的,该反应可用来测定样品中氢化铝锂的含量。为了防止反应过于剧烈,常加入一些二恶烷、乙二醇二甲醚或四氢呋喃作为稀释剂。这一反应提供了一个有用的实验室制取氢气的方法。长期暴露在空气中的样品通常会发白,因为样品已经吸收了足够的水分,生成了由氢氧化锂和氢氧化铝组成的白色混合物。1
氨解反应LiAlH4 的乙醚或四氢呋喃溶液能同氨猛烈作用放出氢气:2LiAlH4 + 5NH3 → [LiAlH(NH2)2]2NH+ 6H2↑1
当氨的量不足时,发生如下反应:LiAlH4 + 4NH3 → LiAl(NH2)4 + 2H2↑1
NH3/LiAlH4比值更小时,则氨中的三个氢都可被取代:LiAlH4 + NH3 → Li[Al(NH2)4]1
配位反应氢化铝锂几乎可以与所有的卤化物反应生成相应的配位铝氢化物,当配位铝氢化物不稳定时,则分解为相应的氢化物。通式为:nLiAlH4 + MXn → M(AlH4)n + nLiX,M(AlH4)n → MHn + nAlH31
因此可通过此方法制备很多金属或非金属氢化物,如:LiAlH4 + 4NaCl → 4NaH + LiCl + AlCl31
复分解反应氢化铝锂可与NaH在四氢呋喃中进行复分解反应,高效的生产氢化铝钠(NaAlH4):LiAlH4 + NaH → NaAlH4 + LiH1
氢化铝钾(KAlH4)可以用二乙二醇二甲醚作为溶剂,以类似的方式制取:LiAlH4 + KH → KAlH4 + LiH1
还原反应氢化铝锂可将很多有机化合物还原,实际中常用其乙醚或四氢呋喃溶液。氢化铝锂的还原能力比相关的硼氢化钠更强大,因为Al-H键弱于B-H键。由于存储和使用不方便,工业上常用氢化铝锂的衍生物双(2-甲氧基乙氧基)氢化铝钠(红铝)作为还原剂,但在小规模的工业生产中还是会使用氢化铝锂。1
能被氢化铝锂还原的官能团主要包括:1
卤代烷被还原成烷烃。碘代烷反应最快,其次是溴代烷和氯代烷。此反应中一级卤代烷(伯卤代烷)性能较好,所得产物发生构型转化,因此认为该反应是SN2机理。二级卤代烷(仲卤代烷)也可用此法还原,三级卤代烃(叔卤代烷)容易发生消除反应,不适用此法。氢化铝锂只能用于还原醇基在附近的炔烃,不能用于还原简单烯烃和芳香烃。1
硅卤化物等还原为硅烷,如:LiAlH4 + SiCl4 → SiH4 + LiCl + AlCl31
羰基化合物(酰胺除外)被还原为醇,如酯和羧酸都可以被氢化铝锂还原成伯醇。在氢化铝锂还原酯的方法发现之前,一般用布沃-布朗还原反应还原酯,即将煮沸的金属钠-无水醇作为还原剂,但这一反应较难进行。醛和酮也可以被氢化铝锂还原成醇,不过一般使用如NaBH4这类更温和的试剂来还原。α,β-不饱和酮会被还原成烯丙醇。1
环氧化合物。当环氧化合物被还原时,氢化铝锂试剂会攻击环氧化合物的位阻小的一端,通常会生成仲醇或叔醇。环氧环己烷会被优先还原成α键(直立键)的醇。1
酰胺和酰亚胺被还原成胺。这类反应一般产率较高,并且用N,N-取代的原料反应比其他要快很多。1
腈被还原成伯胺。另外,肟、硝基化合物以及烷基叠氮都可以被还原成胺。季铵阳离子可被还原成对应的叔胺。1
与醇反应生成烷氧基氢化铝锂:1
LiAlH4 + ROH → LiAl(OR)H3 + H2↑1
LiAlH4 + 2ROH → LiAl(OR)2H2 + 2H2↑1
LiAlH4 + 3ROH → LiAl(OR)3H + 3H2↑1
LiAl(OR)2H2 是将酰胺还原为醛的适宜试剂,LiAl(OC(CH3)3)3H是将酰氯还原为醛的适宜试剂,而利用氢化铝锂不能将酰氯部分还原生成对应的醛,因为氢化铝锂会将后者完全还原为伯醇,因此必须要使用更温和的三叔丁氧基氢化铝锂(LiAl(OC(CH3)3)3H)来还原酰氯。三叔丁氧基氢化铝锂与酰氯的反应比与醛的反应迅速得多,例如在异戊酸中加入氯化亚砜会生成异戊酰氯,这时可利用三叔丁氧基氢化铝锂将异戊酰氯还原为异戊醛,产率能达到65%。1
用途氢化铝锂可作羰基试剂、还原剂,可以制造其他氢化物及硅烷、硼烷等。在医药、香料、农药、染料及其他精细有机合成中用作还原剂。可将醛酮、酸、酸酐、酯、醌、酰氯等还原为醇,将腈还原为伯胺,将卤化烃还原为烃,芳香硝基化合物还原成偶氮化合物。但通常不能使碳—碳双键氢化。除此之外,还用作聚合催化剂、喷气发动机燃料、合成药物等。2
危险特性与健康危害本品加热至125℃即分解出氢化锂与金属铝,并放出氢气;在空气中磨碎时可发火;受热或与湿气、水、醇、酸类接触,即发生放热反应并放出氢气而燃烧或爆炸;与强氧化剂接触猛烈反应而爆炸。5
本品对黏膜、上呼吸道、眼睛及皮肤有强烈刺激性。吸入后,可因喉和支气管的炎症、水肿、痉挛、化学性肺炎、肺水肿而致死。接触后引起烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐等。5
应急方法应急处理隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。不要直接接触泄漏物。小量泄漏:避免扬尘,使用无火花工具收集于干燥、洁净、有盖的容器中。转移至安全场所。大量泄漏:用塑料布、帆布覆盖,减少飞散。与有关技术部门联系,确定清除方法。1
防护措施呼吸系统防护:可能接触毒物时,应该佩戴头罩型电动送风过滤式防尘呼吸器。必要时,建议佩戴自给式呼吸器。1
眼睛防护:呼吸系统防护中已作防护。1
身体防护:穿化学防护服。1
手防护:戴橡胶手套。1
其它:工作现场严禁吸烟。工作毕,淋浴更衣。注意个人清洁卫生。1
急救措施皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗,至少15分钟。就医。1
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。1
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。1
食入:误服者用水漱口,给饮牛奶或蛋清。就医。1
灭火方法:不可用水、泡沫、二氧化碳、卤代烃(如1211灭火剂)等灭火。只能用金属盖或干燥石墨、干燥白云石粉末将火焖熄。1
本词条内容贡献者为:
侯传涛 - 副教授 - 青岛大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
