-01-
间充质干细胞的基本概念
MSCs在标准培养条件下,呈贴壁生长;
MSCs表达CD105、CD73和CD90,不表达CD45、CD34、CD14或CD11b、CD79α或CD19及HLA-DR表面标记;
MSCs在体外诱导可以分化为成骨细胞、脂肪细胞和成软骨细胞
-02-
间充质干细胞产品的异质性
间充质干细胞产品的CQAs
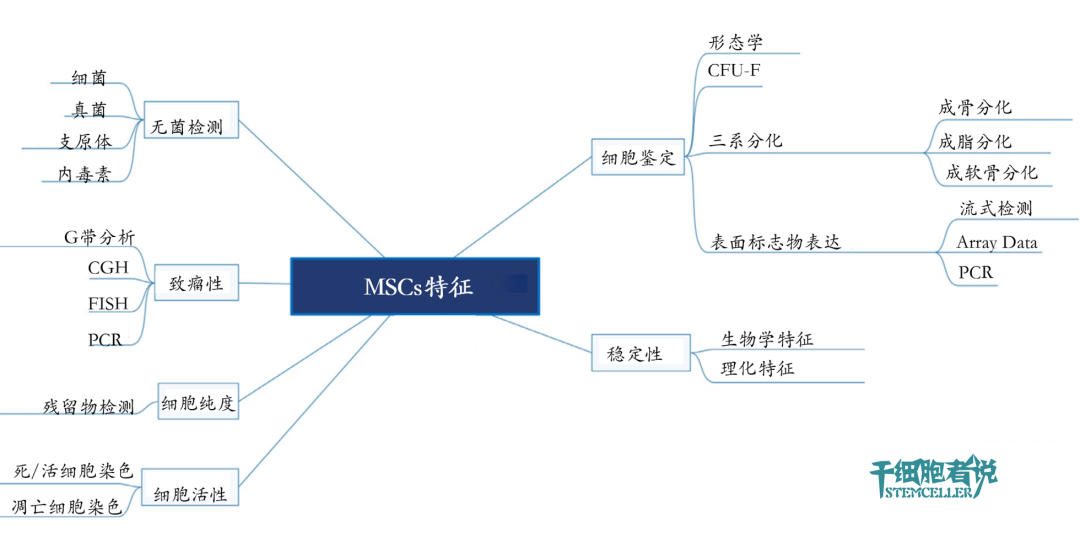
图1. 间充质干细胞的质控体系总览(步步先生绘制)
如何评价细胞产品的CQAs,这是细胞治疗领域面临的独特的一个挑战。传统的化学药品,其结构和效力是可以严格定义。而MSCs产品则不同,这是一种动态“活的药物”。
临床试验开始前,MSCs标准化产品的治疗效力是至关重要的。效力(Potency),FDA给出的定义是 “在适当实验室方法检测下或在预期方式管理条件下,通过大量临床数据获得产品的特殊能力或功能。” 通常,效力用来评价药物产生特定生理功能的浓度或数量,由强度(strength)和效果(effectiveness)两个因素组成,即相同强度(一般指浓度)下所取得的效果。
正是因为如此,开发一种针对MSCs产品效力的测定方法非常有必要,准确地将MSCs产品的CQA与它们的治疗功能相关联。目前,用于间充质干细胞产品效力最广泛的评价方法是:淋巴细胞增殖抑制试验。与免疫调节功能的替代标志物(即IDO表达或TSG-6表达)相比,显然不如后者被认为更能代表效力,因为它可以直接读出生物活性。
间充质干细胞产品的异质性
MSCs是一种异质性细胞群,其基因和蛋白表达谱图与很多因素有关(诸如供体特征,组织来源,分离方法,以及体外扩增培养方式)。不同供体、不同组织来源,甚至不同的制备工艺都可能会造成MSCs终产品出现异质性。
针对GVHD适应症,Mesoblast 公司开展的3期临床试验(NCT00366145)中,Remestemcel-L是来自1个供体扩增至3-4代的MSCs,以满足240名受试者的使用需求。临床试验结果比较积极,但未能达到主要临床终点。 同样是针对GVHD适应,法兰克福大学医院开展的2期临床试验中,使用了来自8个供体混合的1-2代 MSCs,治疗26名患者,取得了77%的总缓解率。
▉ 生物材料
第一种是使用生物材料。在聚乙二醇水凝胶基质上,MSCs的扩增过程可避免细胞表面标志物和细胞因子表达的降低。3D培养系统也有利于MSCs在扩增过程中维持早期传代的表型。
▉ 诱导多能干细胞
▉ 低温保存和复壮培养
-03-
如何增强间充质干细胞的治疗效果
如果建立MSCs产品效力的标准化质控方案,则有助于降低临床失败的风险。虽然不能完全避免临床失败,毕竟MSCs本身也不可治疗所有疾病,它不是包治百病的“万能神药”。临床试验表明,在保证安全性的前提下,MSCs的大剂量输注可保证某些临床应用的有效性。
为了最大限度地发挥临床效力,促进MSCs的“天然属性”,且独立于冷冻保存,扩增倍数,供体和组织来源等,我们可通过生物工程解决方案,可增强MSCs的“天然属性”。
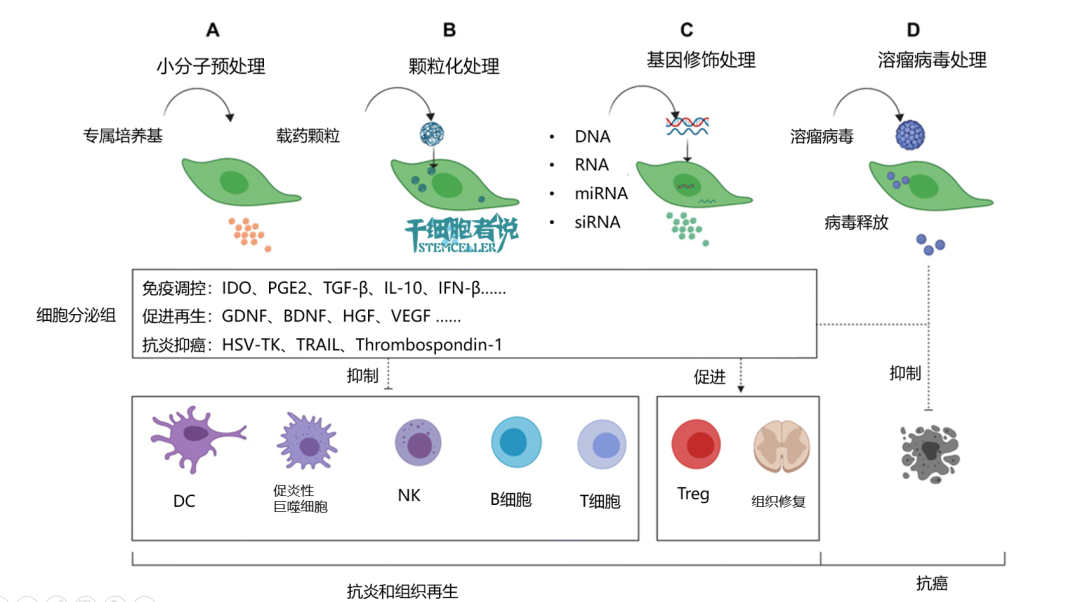
图2. 如何增强间充质干细胞的“天然属性”
A)小分子“预处理”,可促进MSCs免疫调节和再生因子分泌。优点是简单有效,缺点是作用短,仅持续数小时至数天。
B)颗粒化处理,可维持MSCs免疫抑制很长时间,优点是不挑细胞,缺点是成本贵。
C)基因修饰出来,可通过基因修饰MSCs过表达某些因子,要么增强其固有功能,要么过表达其他治疗方法,要么改造成可用于癌症治疗的细胞。
D)溶瘤病毒处理,MSCs可屏蔽溶瘤病毒以躲避自身免疫细胞攻击,并在肿瘤组织中释放病毒以杀死肿瘤细胞。
小分子预处理
载药颗粒处理
小分子“预处理”虽然有用,但效果仅持续数小时到几天。因此,一种小分子封装微粒(MPs)也被用于提高MSCs产品的效力。MP含有生物相容性材料,可以根据其成分、分子量、载药量和药物释放速度,来调控MSCs产品的治疗作用。说白了,就是一种缓释剂。
与经游离的布地奈德(一种肾上腺皮质激素类药)“预处理”的MSCs相比,载有布地奈德的MP处理MSCs后,在体外显示出四倍的IDO活性增强。实验结果是:经IFN-γ刺激后,间充质干细胞产品对外周血单个核细胞(PBMC)的抑制作用提高了两倍。
基因改造
溶瘤病毒处理
溶瘤病毒(OVs)处理也是一个策略,可直接裂解肿瘤细胞,或触发抗肿瘤免疫反应,通过MSCs作为其载体,定位到肿瘤部位,释放溶瘤病毒发挥作用。如果在MSCs中装载OVs,则可有效保护OVs免受机体破坏而影响其有效性,有点类似于“特洛伊木马”。使用MSCs作为OVs载体的一个限制是:MSCs在转导时仅表现出中等感染力。
基于溶瘤病毒技术联合MSCs疗法临床试验(NCT02068794),用于治疗复发性卵巢癌。临床前数据显示,用OV-MSCs治疗SKOV3卵巢癌小鼠后,小鼠寿命明显长于仅用OVs治疗的小鼠。
-04-
文末小结
来源: 干细胞者说


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 干细胞者说
干细胞者说 
