1. 引言
人工智能(AI)正在深刻变革医疗健康领域,尤其在癌症诊断方面展现出巨大潜力。利用深度学习等先进技术分析复杂的生物医学数据,AI模型有望提高癌症检测的速度、准确性和效率,特别是在早期诊断方面,这对改善患者预后至关重要。近年来,涌现出多种基于AI的癌症检测方法,涉及组织病理学图像分析、循环肿瘤DNA(ctDNA)测序等多个维度。
在此背景下,一种名为ECgMLP(Efficient ChannelGrouped MLP)的新型AI模型引起了广泛关注,据报道其在多种癌症的检测中取得了超过99%的惊人准确率。本文旨在深入解析ECgMLP模型本身的技术架构与创新点,并探讨生物医学数据与深度学习融合的未来方向与挑战。
2. ECgMLP模型深度解析
ECgMLP模型作为一个新兴的深度学习架构,在癌症检测领域,特别是基于组织病理学图像的诊断中,展示了引人注目的性能。
2.1 模型概述与起源
ECgMLP最初由一个国际合作研究团队(包括澳大利亚查尔斯达尔文大学的研究人员)开发,主要应用于子宫内膜癌的检测。其架构灵感来源于两个重要的深度学习进展:
- gMLP (Gated Multilayer Perceptron):由Google Brain在2021年5月提出,引入门控机制来控制MLP层之间的信息流。
- Vision Transformer中的卷积 (Convolutions):由Microsoft在2021年3月提出,将卷积操作融入Transformer架构以增强局部特征提取能力。
ECgMLP的核心创新在于首次将卷积操作引入Gated MLP架构,旨在结合MLP的全局信息处理能力和卷积的局部特征提取优势,特别适用于处理高分辨率的病理图像。
2.2 技术架构与潜在创新点
尽管ECgMLP的开源代码和详细的消融研究报告目前难以获取,限制了对其内部机制的完全复现和评估,但根据现有信息和相关领域知识,我们可以推测其关键技术特点和潜在创新点:
- 卷积与门控MLP的融合:这是ECgMLP最核心的贡献。通过将卷积层嵌入到门控MLP块中,模型可能能够更有效地捕捉病理图像中的空间层级特征,从细微的细胞结构到更宏观的组织排列。
- 高效通道分组(Hypothesized):模型名称中的“Efficient Channel Grouped”暗示可能采用了类似分组卷积的策略。这种策略可以在减少计算量和参数的同时,促进通道间的信息交互,提高模型效率。
- 上下文感知的门控机制(Hypothesized):可能采用了比标准gMLP更复杂的门控机制,能够根据输入的图像上下文动态调整不同特征通道或空间位置的重要性,聚焦于诊断相关的关键区域。
- 多尺度特征融合(Hypothesized):为了识别不同大小和形态的癌变区域,ECgMLP可能集成了多尺度特征提取和融合策略。
- 自注意力机制与优化:研究提到ECgMLP利用了自注意力机制和高效训练进行优化,这有助于模型捕捉长距离依赖关系并提升训练效率和泛化能力。
以下是一个假设性的ECgMLP基础模块的简化表示:
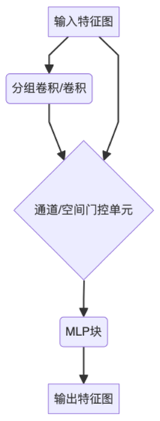
2.3 报告性能与验证
ECgMLP在多个癌种检测任务上报告了极高的准确率:
- 子宫内膜癌: 99.26%
- 结直肠癌: 98.57%
- 乳腺癌: 98.20%
- 口腔癌: 97.34%
尤其在子宫内膜癌检测方面,其准确率显著优于传统病理学家的人工诊断准确率(约78.91% - 80.93%),也据称超越了基于迁移学习和定制模型的其他AI方法,同时保持了计算效率。
3. 生物医学数据与深度学习融合:未来方向与挑战
ECgMLP和上述各种模型的探索,共同指向了生物医学数据与深度学习深度融合的未来趋势,但也伴随着诸多挑战。
3.1 数据层面的融合与挑战
-
多模态数据融合: 未来的趋势是整合来自不同维度的数据,例如:
-
病理图像 + 基因组学/转录组学: 将形态学信息与分子层面的改变(如驱动基因突变、表达谱)相结合,实现更精准的诊断、分型和预后预测。
-
液体活检 + 医学影像: 结合血液中的分子信号和影像学(CT, MRI, PET)上的病灶信息,提高检测灵敏度和定位准确性。
-
多组学液体活检: 如EMMA和Freenome等公司的探索,结合cfDNA甲基化、突变、片段组学、蛋白质组学、转录组学等多种分析物。
-
挑战: 如何有效对齐、整合异构数据,处理不同数据的噪声和缺失,以及开发能够有效利用多模态信息的模型架构。
-
数据质量与标准化: 病理图像的质量受染色、扫描等因素影响;液体活检信号微弱,易受样本处理影响。需要标准化数据采集和处理流程。
-
大规模、多样化数据集: 构建能够代表广泛人群和临床情境的大规模、高质量、多样化的数据集是训练鲁棒AI模型的基石。数据共享和隐私保护是关键。
3.2 技术层面的突破方向
- 可解释性AI (XAI): 对于高风险的医疗决策,模型的可解释性至关重要。需要开发能够解释预测依据(例如,在病理图像上高亮显示可疑区域,或指出关键的甲基化位点)的方法,增强医生对AI的信任和协作。
- 自监督/弱监督学习: 减少对大量精细标注数据的依赖,利用海量无标注或弱标注数据进行预训练(如Virchow, CHIEF),提高模型通用性。
- 联邦学习: 在保护数据隐私的前提下,允许多个机构协同训练模型,扩大有效数据规模。
- 更高效、鲁棒的模型架构: 持续探索新的网络结构(如ECgMLP的尝试),以更低的计算成本实现更高的性能和更好的泛化能力。
- 因果推断: 超越相关性,探索模型能否理解癌症发生的因果机制,从而做出更可靠的预测。
3.3 应用与转化层面的挑战
- 严格的临床验证: AI模型必须经过大规模、多中心、前瞻性的临床试验验证,证明其在真实世界中的临床有效性和安全性,而不仅仅是回顾性研究中的高性能。
- 泛化性与稳健性: 确保模型在不同人群、不同医疗设备、不同操作流程下仍能保持稳定可靠的性能,是临床落地的关键。需要特别关注模型在罕见亚型或非典型病例上的表现。
- 监管审批: AI医疗器械需要通过严格的监管审批流程(如FDA, NMPA)。审批标准和路径仍在不断发展中。
- 临床工作流整合: AI工具需要无缝集成到现有的临床工作流程中,易于医生使用,并能真正提高效率或改善决策,而不是增加负担。
- 成本效益分析: 需要证明AI解决方案相比现有标准的成本效益,才能被医疗系统广泛采纳。
- 伦理考量: 数据隐私、算法偏见(如在特定人群中表现不佳)、责任界定(AI出错时谁负责)等伦理问题需要审慎对待。
- 早期检测的平衡: 对于筛查类应用,如何在提高早期敏感性(尤其是Stage I)和维持高特异性(减少假阳性带来的过度诊断和焦虑)之间取得最佳平衡,是一个核心挑战。
4. 结论与未来展望
ECgMLP模型以其报道的超高准确率吸引了业界的目光,其将卷积引入门控MLP的架构思路具有一定的创新性。然而,当前关于该模型的公开信息有限,尤其缺乏透明的实现细节、开源代码以及最重要的——在大型独立数据集上的严格验证。因此,尽管其报告性能令人鼓舞,但对其真实能力和临床价值的判断仍需持审慎态度,亟待后续更详尽、更透明的研究来证实。
放眼整个AI癌症检测领域,我们正处在一个快速发展的时代。无论是基于组织病理图像的基础模型(如CHIEF、Virchow),还是基于液体活检的多癌种早期检测技术(如利用cfDNA甲基化、多组学融合的各种方法),都在不断取得进展。这些技术路径各有侧重,前者在辅助诊断和预后判断方面潜力巨大,后者则为癌症的早期筛查带来了革命性的希望。
未来展望(包含预测性观点):
- 技术融合: 我们预测,未来的癌症AI诊断将更加依赖多模态数据融合,结合形态学、分子生物学、影像学和临床信息,提供更全面、更精准的决策支持。
- 模型演进: 基础模型和自监督学习将继续发展,降低对标注数据的依赖;可解释性AI将成为临床接受的关键;针对特定任务(如早期筛查、耐药性预测)的专用模型也将不断优化。
- 临床转化加速: 随着更多大规模临床验证研究的完成和监管路径的明确,预计未来5-10年内,将有更多AI癌症检测工具进入临床实践,首先可能是在病理辅助诊断、高风险人群筛查等领域。
- 挑战持续: 但转化之路并非坦途。数据壁垒、泛化性难题、成本效益证明、伦理法规完善以及临床工作流整合仍是需要持续攻克的挑战。
总而言之,AI在癌症检测领域的革命已经拉开序幕。ECgMLP是这场革命中的一个值得关注的探索者,但整个领域的进步需要依靠开放、协作、严谨的研究,以及对技术、数据和临床应用的深刻理解。只有这样,AI才能真正成为战胜癌症的有力武器,惠及广大患者。